Bevezetés
Szerte a világon, így Magyarországon is egyre nagyobb jelentőséget kap az élőlények genetikai állományának védelme. A fokozódó környezeti ártalmak /légszennyeződés, vegyszerek/ károsítják az élőlényt és környezetét, csökkentik a populáció fennmaradásának esélyét. Bizonyos környezeti tényezők változását az egyed nem képes tolerálni egy adott határon túl, továbbá a genom valamely szintjén bekövetkező mutációk a tolerancia tartomány megváltozását eredményezhetik. Ezek a hatások a populáció /faj/ egyedszámának csökkenését, ill. a faj kipusztulását vonhatják maguk után. A megoldás egyik módja a ritka és veszélyeztetett fajok védetté nyilvánítása, termőhelyük védelme. Kérdés azonban, hogy tehetünk-e egyértelmű megállapításokat bizonyos gombafajok kipusztulásáról, vagy számuk jelentős csökkenéséről.
A gombáknál a termőtest megjelenése alapján következtetünk a populáció jelenlétére, azonban a termőtest hiánya nem jelenti mindig a populáció kipusztulását. A környezeti tényezők sajátos alakulása folytán, föld alatti micélium formájában akár évtizedekig is vegetálhat a gomba, ivaros folyamatok nélkül. A micélium felkutatása, határozása pedig szinte teljesíthetetlen feladatot ró a mikológusokra.
Bizonyos fajok ritkának tűnhetnek azért, mert felkutatásukkal, tanulmányozásukkal kevesen foglalkoznak. Pl. Magyarországon meglehetősen ritkának tartják a Tuber fajokat, a Cseh- és Szlovák Köztársaságban az összes Tuber sp. védelemre javasolt, holott bizonyos szarvasgomba fajok Magyarországon - és valószínűleg Közép-Európában is - gyakoriak /Bratek, ex verbis /.
A gombafajok megőrzésének másik - az előző módszert kiegészítő - szükséges útja az egyes fajok fenntartása laboratóriumi tisztatenyészetek formájában. Itt cél lehet egy, a flórát jól reprezentáló, a védendő és ritka fajokkal kiegészített gyűjtemény kialakítása, párosítva mindazokkal a fajokkal, amelyeknek gazdasági alkalmazása nagy jelentőséggel bír.
Tenyészetgyűjtemények /gombagénbankok/
Becslések szerint több mint 250 ezer gombafaj létezik a világon /HAWKSWORTH és mts-ai, ' 1983/, közéjük tartoznak természetesen a szabad szemmel nem látható, mikroszkopikus gombák is. A világ tenyészetgyűjteményeiben kb. 170 ezer izolátumot /7 ezer fajt/ tárolnak /WU, 1986/, amelyek valamilyen módon /fermentáció, termesztés stb./ hasznosításra kerültek. Elmondható, hogy a génbankok növekedése az utóbbi években egyre nagyobb mérvű. Pl. az ATCC-ben /American Type Culture Collection/ 1973-ban közel 5 ezer, 1983-ban viszont már több mint 16 ezer izolátumot tartottak fenn. Ebből az ehető fajok száma 143 /JONG és DAVIS, 1986/. Természetesen ma már több, hasonló nagyságú gyűjtemény létezik a világon. Az egyik legrégebbi központ az 1904-ben Hollandiában alapitott CBS /Centraalbureau voor Schimmelcultures/, ide tartozik még az angliai CMI /Commonwealth Mycological Institute/ és a DSM /Deutsche Sammlung von Mikroorganismen/ göttingeni székhellyel.
A génbankok feladata, hogy a fajokat reprodukcióképes állapotban, mutációk nélkül hosszútávon megőrizze. Az ott tárolt anyag természetesen referenciaként is szolgál a szakterületet kutatók számára. A nagy, regionáls központok mellett azonban szükség van kisebb, kevesebb /néhány száz/ izolátumból álló, speciális igényeket kielégítő gyűjteményekre is. Ezzel a céllal alakult a Magyar Természettudományi Múzeum gyűjteménye.
Gombagénbank a Magyar Természettudományi Múzeumban
A tenyészetgyűjtemény kialakítását dr. Bohus Gábor kezdte el az 1950-es években. Az első tisztatenyészetek kétspórás csiperketörzsek voltak, amelyek termesztésbe vonásával a magyarországi terméseredményeket sikerült jelentősen megnövelni. A génbankban szerepeltek olyan xilofág fajok, melyeknek az épületgombásodás elleni fungicidek kipróbálásánál volt nagy szerepük. Bizonyos patogén gombák elleni, nagygombák által termelt fungicidek kipróbálásában is szerepet kaptak a Növénytár tisztatenyészetei. Ezenkivül a tenyészeteket felhasználták még antikarcinogén anyagok tesztelésénél és enzimprodukció vizsgálatánál is. A 80-as évekre sikerült dr. Bohus Gábornak az általa leírt faj, az Agariaus macrosporoides izolátumaiból a faj kísérleti termesztését megoldani /BOHUS, 1987/. Az izolátumok számának növekedésével célszerűnek látszott új hosszútávú tárolási mód - a cseppfolyós nitrogénes tárolás - bevezetése a periodikus átoltás helyett, amely révén lehetővé vált a veszélyforrások /l. később/ kiküszöbölése és a gyűjtemény folyamatos bővítése a fent taglalt szempontok alapján. 1991-ben az Országos Tudományos Kutatási Alap támogatásának elnyerésével nyílt lehetőség az új tárolási technika kidolgozására dr. Bohus Gábor témavezető irányításával, dr. Vasas Gizella és a cikk szerzője részvételével.
Hagyományos fenntartási módszerek
A már klasszikusnak nevezhető módszer, az izolátumok fenntartása szilárd táptalajon, periodikus átoltással, több hátránnyal jár. A micélium elöregedése és a táptalaj kiszáradása miatt, a tenyészeteket az átszövetés után 3-6 hónappal szükséges átoltani. A tárolási hőmérséklet csökkentésével /5-10°C/ ez az időszak 6-12 hónapra meghosszabbítható. Az átoltás ideje alatt a tenyészetek baktériumokkal, penészgombákkal fertőződhetnek. Hosszabb idő eltelte után mutációk léphetnek fel, amelyek a micélium morfológiai sajátosságainak megváltozásában, a növekedési paraméterek változásában, a termesztett fajoknál a termőképesség csökkenésében figyelhetők meg. Az 1950-es évekig a típusgyűjteményekben a periodikus átoltás volt az egyedüli ajánlott módszer bizonyos gombacsoportok fenntartására /FENNEL, 1960/. Emellett a fenntartás /különféle, sokszor speciális táptalajok elkészítése, átoltás/ meglehetősen munkaigényes folyamat.
A tárolási idő tovább hosszabbítható, ha ferde agaron tartott izolátumokat paraffinolajjal fedik le, ezáltal a micélium oxigénfelvétele erőteljesen csökken, így az átoltás - fajtól függően - több évvel a lefedés után történhet /HARTSELL, 1947/. A 40-es években több gombakultúrát így őriztek a New York-i Botanikus Kertben /New York Botanical Garden/ /STEBBINS és ROBINS, 1949/ és az Amerikai Tipustenyészet Gyűjteményben /American Type Culture Collection, ATTC/ IWEISS és OTEIFA, 1953/. Bizonyos szaporítóképletek /spórák, konidiumok/ fagyasztva-szárítás után - megfelelő tárolás mellett - hosszú ideig életképesek maradnak, azonban a micélium nem éli túl a fagyasztva-szárítást /JONG, 1978/.
Tárolás alacsony hőmérsékleten
A közfelfogással ellentétben az ultraalacsony hőmérséklet /-150°C alatt/ nem káros az élő szervezetre. Ebben a hőmérséklet intervallumban ugyanis az élő sejtekben a kémiaibiokémiai folyamatok sebessége gyakorlatilag nulla, így az élet látens formában megőrződik. Az élő szervezetet károsító hatások a hűtés és felmelegités alatt mennek végbe. Ezek a hatások a hűtés-melegítés sebességének optimális megválasztásával, ill. bizonyos védőanyagok adagolásával csökkenthetők vagy megszüntethetők. A gyors /l-10°C/min./ és lassú /0,l-l°C/min./ hűtés hatására más-más fizikai változások játszódnak le az élő sejtben. Ezeket az 1. ábra szemlélteti. Az extracelluláris állományban a víz túlhűlése és a mindig jelenlevő fagyáscsökkentő anyagok jelenléte következtében -5°C körül kezdődik a jégkristályok képződése. -5 és -15°C között az intracelluláris tér túlhűtött állapotban marad, feltehetően azért mert a sejtmembrán megakadályozza a jég behatolását.
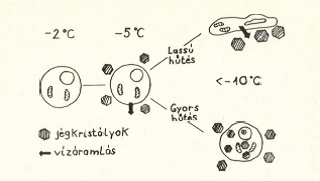
1. ábra
Az exttacelluláris oldatok betöményedése következtében viz áramlik ki a sejtekből. Eddig a pontig a kétféle hűtési sebesség mellett azonosak a fizikai folyamatok. Ha a hűtés elég lassú, akkor a sejt képes az extracelluláris térben lejátszódó jégkristályképződést, ill. az ott jelenlevő oldatok betöményedését vízvesztéssel ellensúlyozni. Ennek eredményeképpen az intracelluláris oldatok betöményednek, a sejt nem fagy meg, ellenben dehidratálódhat. A sejtek csak egy bizonyos térfogatcsökkenésig /kritikus sejttérfogat, amely növényi sejteknél a kiindulási sejttérfogat 40-50%-a/ képesek tolerálni a külső és belső tér ozmózisnyomás különbségéből adódó vizvesztést, ezen tul akrioprotektiv hatását először bikaspermiumokon tapasztalták 1943-ban /POLGE és mtsai, 1949/. Mára a kriobiológiai munkák egyik legfontosabb segédeszközévé vált. Jelentőségét fokozza, hogy az élő szervezetekben is előfordul és magasabb koncentrációban sem toxikus, viszonylag olcsón beszerezhető és autoklávozással sterilizálható.
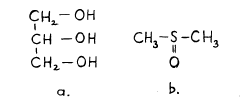
2. ábra Glicerin /a/ és dimetil-szulfoxid /b/ szerkezeti képlete
A glicerin mellett a másik fontos'védőanyag a DMSO, amelynek védőhatásáról először 1959-ben tudósítottak. A glicerinhez hasonlóan vízben jól oldódik, könnyen áthatol a sejtmembránon. Hátránya, hogy csak szűréssel sterilizálható és nagyobb koncentrációban mutagén hatása lehet. Az extracelluláris védőanyagok kisebb jelentőségűek, hatásmechanizmusuk kevéssé ismert. Ezeket általában alacsony koncentrációban, főként gyors fagyasztásnál alkalmazzák. Lehetnek kisebb molekulatömegűek, pl. mannitol, szorbitol, vagy nagy molekulatömegüek /dextrán, albumin/.
A krioprotektív anyagok hatásmechanizmusa
Hűtés során két fontos károsodást kell kivédeni, a sejtoldatok betöményedését, a sejtek dehidratálódását, amely lassú fagyasztásnál következik be, ill. gyors hűtésnél az intracellulárisan bekövetkező jégkristályképződést és az ezt követő átkristályosodást. A glicerin, amely ozmotikusán inaktív, kolligatív sajátságánál fogva képes arra, hogy megakadályozza a sejtoldatok betöményedését. Hiába csökken tehát a sejt víztartalma, a glicerin jelenléténél fogva gátolja meg a betöményedést és az ezzel járó térfogatcsökkenést. Egyes feltételezések szerint - NMR spektroszkópiai mérések alapján - a glicerin és a hozzá hasonló polihidroxi-vegyületek képesek a vízmolekulákat a membránfelszíneken helyettesíteni, ezáltal az irreverzibilis membránkárosodást kivédeni /CLEGG és mtsai, 1982/. Valószínűnek látszik, hogy a glicerin nem képes megvédeni a sejtet a gyors hűtéskor bekövetkező intracelluláris jégkristályképződéssel szemben. A túlhűtött sejtekben glicerin mellett is megindul a jégkristályképződés. A glicerin koncentrációjának növelése csak az optimális hűtési sebességet tolja el. Az extracellulárisan ható anyagok részben kolligatív sajátosságuknál fogva védenek, másrészt viszont - eddig kevéssé ismert módon - a sejtmembránnal történő kölcsönhatás következtében fejtik ki védőhatásukat.
A tenyészetek hosszútávú fenntartásának módszere az MTM Növénytárában
Előkészítés
A begyűjtött és pontosan meghatározott gombatermőtestekből leoltással tisztatenyészetet készítünk. A kettétört termőtestből a kalap és a tönk találkozásánál steril szikével vagy dugófuróval "szövet"-darabkát metszünk ki, melyet agar médiumra viszünk át. Fontos, hogy a termőtest minél fiatalabb legyen, tapasztalat szerint ugyanis a fiatal termőtestből nyert szövetdarabkák jobban megerednek. Ha a termőtest nedves, a leoltás után gyakoribb a befertőződés. Egy termőtest-kollekcióból több izolátumot is készítünk és csak abban az esetben visszük tovább a vonalat, ha az izolátumok morfológiai tulajdonságai és növekedési paraméterei hasonlóak. /Bizonyos fajoknál a fenti út nem járható. Pl. Morchella fajok leoltásakor gyakran erős bakteriális fertőzés tapasztalható. Ekkor érdemes próbálkozni multispórás tenyészetek előállításával, ez legtöbbször eredményre vezet./ A kémcsőbe ferde agarra leoltott gombát átszövetés után Petri-csészébe oltjuk át. A megfelelő méret elérése után steril dugófuróval a tenyészet pereméről veszünk ki 8 mm átmérőjű korongokat, amelyeket ezután csavaros kupakkal ellátott 2 ml-es polipropilén ampullába helyezünk. Egy ampullába 3 db korongot helyezünk és erre 1,5 ml 10 tf%-os glicerint pipettázunk. Ily módon egy izolátumból 5 db ampullát t öltünk meg. Dimetil-szulfoxidot nem alkalmazunk krioprotektív anyagként.
Hűtés
Mint az előzőekben utaltam rá, az eljárás kardinális kérdése a hűtés és visszamelegítés idejének, a folyamat sebességének megválasztása. Manapság már kaphatók cseppfolyós nitrogénnel hűtő, számítógéppel egybeépített fagyasztóberendezések, amelyeken az általunk kiválasztott fagyasztási görbe programozható be. Ezek a készülékek azonban elég drágák és a hűtésre sok cseppfolyós nitrogént használnak fel. Az OTKA kutatási program keretében költségvetésünk nem tette lehetővé fagyasztóberendezés vásárlását. Létezik azonban ennél jóval egyszerűbb és főleg olcsóbb módszer a probléma kiküszöbölésére. a cseppfolyós nitrogén tárolásánál, annak gőzében hőmérsékleti gradiens alakul ki, azaz a hőmérséklet a folyadéktól távolodva csökken. Megfelelő magasságba helyezve a fagyasztandó anyagot, az optimálishoz közeli fagyasztási görbét kapunk. A göbe beállítása a glicerinoldat lehűlésének különböző magasságokban történő mérésével lehetséges. Általában 1°C/min. hőmérséklet-csökkenés optimális a gombatenyészeteknek. Ezt kb. -40°C-ig fontos tartani, utána nem szükséges kontrollálni a hűtést, a tenyészet belemeríthető a cseppfolyós nitrogénbe. A Növénytárban alkalmazott fagyasztási görbét a 3. ábra mutatja.
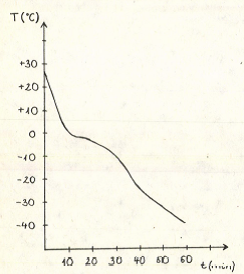
3.ábra Tenyészetek hűtési görbéje /10 tf%-os glicerin/
Tárolás
Számos előnye mellett a cseppfolyós nitrogénben történő tárolás a hagyományos fenntartási módszerekkel szemben költségesebb. A költségek két részből tevődnek össze: egyrészt a tárolótartályok árából, másrészt a nitrogénszállításból. A biztonsági szempontok legalább két tartály beszerzését indokolják. Az egyikben a tenyészeteket szükséges tárolni, a másikban pedig elegendő nitrogént az elpárolgó pótlására. Természetesen, ekkor még fennáll a veszélye annak, hogy a tenyészettároló tartály esetleg megsérül, s ekkor a lefagyasztott izolátumok megsemmisülnek. Ha az anyagi lehetőségek engedik, érdemes ugyanazt az izolátumot egy másik tartályban is elhelyezni, minimálisra csökkentve ezzel a kockázatot. A tárolási célokra felhasználható tartályok vákuumszigetelésűek, alumíniumból vagy rozsdamentes acélból készülnek, utóbbiak nemcsak nitrogén, hanem egyéb gázok /pl. oxigén, argon/ tárolására és szállítására is felhasználhatók. A tartályok nagysága a néhány litertől, a több száz vagy ezer literig terjed. Párolgási rátájuk a tárolókapacitás és a nyakátmérő függvénye. A kisebb térfogatú 2-40 literes tartályok párolgási rátája 1-3 dl/nap, a nagyobb, 300-900 literes tartályoké 4-8 l/nap. Tapasztalataink szerint a tartályok gyakori nyitása-zárása erősen megnövelheti a párolgási veszteséget. A jó minőségű tartályok várható élettartama 10-20 év. Ez függ természetesen a kezelésüktől. Gyakori hőmérséklet-változás és akár kisebb mechanikai behatás /ütés, leejtés/ hatására a tartály falában repedések keletkezhetnek, aminek következtében a vákuumszigetelés csökken. Ez a nitrogén fokozottabb párolgását idézi elő, ami jelentős költségnövelési tényező. Az MTM Növénytárában a téma indulásakor alumínium tartályok kerültek beszerzésre. 1 db 21 l-es nitrogéntároló tartály /párolgása 0,25 l/nap/ és 1 db 40 l-es tenyésztároló tartály /párolgása 0,29 l/nap/, amelyben kb. 1000 db 2 ml-es műanyag ampulla /kriotubus/ helyezhető el rendszerezetten. Természetesen az izolátumok számának növekedésével további tartályok is beszerzésre kerülnek. A műanyag ampullák előnye a hagyományos üvegampullákkal szemben, hogy a tenyészetek vitalitását kedvezően befolyásolják /SIMIONE és mtsai, 1977/. Nem törnek, nem kell őket forrasztani, hátrányuk viszont, hogy különösen többszöri felhasználásnál nem záródnak tökéletesen és cseppfolyós nitrogénben tárolva átengedhetik a nitrogént. Ez különösen veszélyes lehet patogén mikroorganizmusok tárolása esetén. A növénytári tenyészeteknél azonban ez a lehetőség nem áll fenn, hiszen az általunk tárolt gombák nem agresszívek, csak megfelelő szubsztrátumon képesek fennmaradni. Egyes gyűjteményekben, ahol tárolásra üvegampullákat használnak, ezeket forrasztás után szivárgásra tesztelik. Metilénkék oldatba helyezve a szivárgó ampullákban megjelenik a festékanyag, amely elszínezi az oldatot. tubusukat hűtés után ampullatartókra /holderek/ helyezzük. Az ampullatartók egy nyéllel rendelkező, szitaszerű fenékkel ellátott hengerbe /kaniszter/ kerülnek és ezt az együttest süllyesztjük a folyékony nitrogénbe /4. ábra/.
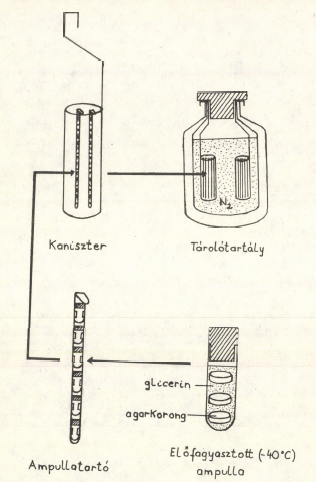
4.ábra
Az ampullák elrendezése, jelölése
Az általunk használt GT-40-es típusú tartályba 1020 2 ml-es ampulla helyezhető el /10 kaniszter, kaniszterenként 17 ampullatartó és ampullatartónként 6 ampulla/. Minden egyes ampulla öt számjegyű jelölést kap. Az első 2 számjegy a kaniszter számát jelöli /01-10/, a második kettő az ampullatartó számát /01-17/, az utolsó pedig az ampulla pozícióját a holderen /1-6/, alulról felfelé növekvő sorrendben számozva. A jelölést alkoholos filctollal végezzük. Tapasztalataink szerint a festéket az alacsony hőmérséklet nem károsítja.
Újraélesztés
Izolátumonként 5-5 ampullát helyezünk el a tárolótartályban, ezekből kettőt melegítünk fel. A tenyészeteknek vizsgáljuk a tisztaságát, vitalitását és virulenciáját, továbbá morfológiai sajátosságait. Az újraélesztés 35-40°C-os vízfürdőben történik addig a pontig, amíg az utolsó jégkristályok is felolvadnak. A felmelegítés néhány percig tart. Az ampullák alkohollal történő gondos lemosása után az agarkorongokat bonctű segítségével Petri-csészébe visszük át. Esetleg előfordulhat, hogy a korong felületén található micéliumháló a melegítés folyamán leválik. Ebben az esetben a korongok kiemelése után a glicerinoldatot a benne található micéliumdarabkákkal együtt a médiumra öntjük. A Petri-csészéket ezután 25°C-on 90%-os relatív nedvességtartalom mellett inkubáljuk. A micélium - fajtól függően - 1-14 nap eltelte után indul fejlődésnek. Naponta jegyezzük a tenyészetek átmérőjét 70 mm-es átmérő eléréséig. A hűtési procedúrát akkor tekintjük elfogadottnak, ha a visszaélesztett gomba nem fertőzött, a korongok több mint 50%-a fejlődésnek indul és morfológiai sajátosságaik megegyeznek. Az újraélesztett kultúrák növekedési- és produkcióképességét több szerző is vizsgálta, tapasztalataik szerint nincs szignifikáns eltérés a vizsgált paraméterekben a kontrollal szemben /HWANG, 1968; KNEEBOONE és mtsai, 1974/.
Összefoglalás
Makrogomba-kultúrák hosszútávú fenntartására az alacsony hőmérséklet /-150 és -200°C között/ a legalkalmasabb. Ezzel a módszerrel kiküszöbölhetők a hagyományos fenntartási technikák veszélyforrásai. Az élő anyag genetikai károsodások nélkül viseli el a tárolást. A Magyar Természettudományi Múzeum Növénytára - a folyékony nitrogénben történő tárolási módra építve - makrogomba-génbankot létesített. A génbankban a flórát reprezentáló, védendő és gazdasági hasznosíthatósággal bíró fajok kapnak helyet.
Irodalom
BOHUS, G. /1987/: Supplementary investigations concerning the introduction of Agaricus macrosporoides into cultivation. Acta Agron. 36: 245-248.
CLEGG, S.J.— SEITZ, P.— SEITZ, W.— HAZLEWOOD, C.F. /1982/: Cellular responses to extreme water loss: The water replacement hypothesis. Cryobiology 19: 306-316.
FENNELL,I.D. /1960/: Conservation of fungus cultures. Bot. Rew. 26: 79-141.
HARTSELL, S.E. /1947/: The longevity of bacterial cultures under paraffin oil. Journ. Bact. 53: 801.
HAWKSWORTH, D.L.— SUTTON, B.C.— AINSWORTH, G.C. /1983/: Ainsworth and Bisby's Dictionary of the Fungi. 7th edition. Commonwealth Mycological Institute, Kew.
HWANG, S. /1968/: Investigation of ultra-low temperature for fungal cultures. I. An evaluation of liquid nitrogen storage for preservation of selected fungal cultures. Mycologia 60: 613-626.
JONG, S.C. /1978/: Conservation of cultures. In: CHANG, S.T.— HAY, W.A. /editors/: The Biology and Cultivation of Edible Mushrooms. Academic Press, New York.
JONG, S.C.— DAVIS, E. /1986/: Germplasm preservation of edible fungi in culture through cryogenic storage. Proc. Int. Symp. Scientific and Technical Aspects of Cultivating Edible Fungi, The Penn. State Univ., USA.
KNEEBONE, L.R.— HWANG, S.W.— SCHULTZ, P.G.— PATTON, T.G. /1974/í Comparative production performance of stock cultures of eight strains of Agaricus bisporus preserved by liquid nitrogen freezing and by repeated vegetative transfer. Mushroom Sei. 9 /1/: 229-235.
MAZUR, P. /1977/: The role of intracellular freezing in the death of cells cooled at supraoptimal rates. Cryobiology 14: 251-272.
MERYMAN, H.T. /1974/: Freezing injury and its prevention in living cells. Ann. Rev. Biophys. Bioeng. 3: 341.
POLGE, C.— SMITH, A.U.— PARKES, A.S. /1949/: Revival of spermatozoa after vitrification and dehydration at low temperatures. Nature 164: 666.
SIMIONE F.P.—DAGETT, P.—GRATH, M.—ALEXANDER M.T. /1977 / : The use of plastic ampoules for freeze preservation of microorganisms. Cryobiology 14: 500-502.
STEBBINS, M.E.— ROBBINS, W.J. /1949/: Mineral oil and preservations of fungus cultures. Mycologia 41: 632-636
WEISS, F.A.— OTEIFA, B.A. /1953/: Preservations of cultures of microorganisms under oil seal. Phytopath. 43: 407
WU, L.C. /1986/: Strategies for conservation of genetic resources. Proc. Int.' Symp. Scientific and Technical Aspects of Cultivating Edible Fungi. The Penn. State Univ., USA.
Long-term preservation of fungus cultures, CSABA LOCSMÁNDI, Botanical Department of the Hungarian Natural History Museum, 1097 Budapest, Könyves K. körút 40.
At the present time the most suitable method for longterm preservation of fungus cultures is their storage in liquid nitrogen at -150 — -200°C. The maintenance of fungus cultures by cryogenic freezing eliminates the risk of conventional methods and prevents genetic damage of the material preserved in living state.
The author reports about the establishing a mushroom culture collection at the Botanical Department of the Hungarian Natural History Museum. The Culture ollection serves as depository for several species of floristical and economical importance.
A cikk megjelent: MIKOLóGIAI KÖZLEMÉNYEK, Vol. 31 No. 1-2 1992

